Теоретические основы процесса коррозии нефтепромыслового оборудования
Сегодня ущерб от коррозии в развитых странах оценивается в 2–4% ВВП, а потери от вышедших из строя металлических конструкций, изделий и оборудования составляют 10–20% годового производства стали. Эти цифры делают необходимым всестороннее теоретическое изучение коррозии, которое, в свою очередь, служит основой для разработки методов борьбы с коррозионными процессами.

Коррозией называется процесс разрушения материалов в результате взаимодействия с агрессивной средой. При этом в результате химического или физико-химического взаимодействия с окружающей средой происходит потеря их эксплуатационных свойств. Нередко под коррозией подразумевается лишь процесс разрушения металлов, что не совсем правильно, так как понятие коррозии применимо и к неметаллам. Тем не менее механизмы и кинетика коррозионных процессов для металлов и неметаллов будут различными.
Коррозия металлов представляет собой разрушение их поверхности в результате химического или электрохимического взаимодействия с агрессивной средой. Термодинамически коррозия металлов возможна в случае, если в результате коррозионного процесса уменьшается свободная энергия системы.
Менее известны случаи коррозии полимеров. Применительно к ним наиболее распространено понятие «старение», аналогичное термину «коррозия» для металлов. Примерами могут служить старение резины под действием кислорода или сероводорода, разрушение некоторых пластиков под воздействием ультрафиолета или осадков, а также биологическая коррозия. Скорость коррозии, как любой химической реакции, очень сильно зависит от температуры. Повышение температуры на 100°С может увеличить скорость коррозии на несколько порядков.
ЭКОНОМИЧЕСКИЕ ПОТЕРИ ОТ КОРРОЗИИ
В мире коррозия ежегодно приводит к миллиардным убыткам, причем основной ущерб, причиняемый ею, заключается не в потере металла как такового (в мире до 20% металла в год уходит именно в коррозионные отходы), а в разрушении дорогостоящих изделий и оборудования. Еще больший ущерб наносят косвенные потери при простоях оборудования при замене прокорродировавших деталей и узлов, утечке нефти и газа, нарушении технологических процессов. Убытки от коррозии, таким образом, нельзя сводить лишь к прямым потерям — стоимости разрушившихся конструкций, замены оборудования и затратам на мероприятия по защите от коррозии.
В США, по данным NACE, ущерб от коррозии, включая затраты на борьбу с ней, составляют 3,1% ВВП ($276 млрд в год), в Германии — 2,8% ВВП. В пределах 2–4% ВВП находится этот показатель и в других развитых странах. При этом потери металла, включающие вышедшие из строя металлические конструкции, изделия, оборудование, составляют 10–20% годового производства стали.
В нашей стране нет официальной статистики, которая бы отражала экономический ущерб от коррозии, но, по нашим оценкам, он составляет не менее 5% от ВВП. Это значит, что объем продукции, эквивалентный годовому производству Новолипецкого металлургического комбината, ежегодно тратится только на восполнение черного металла, пораженного коррозией.

КЛАССИФИКАЦИЯ КОРРОЗИИ
Самый распространенный вид коррозии — ржавчина, но коррозия и ржавчина — не синонимы. Есть и другие виды коррозии, которые не менее, а порой и более пагубны для нефтегазового оборудования, в частности, так называемая щелевая коррозия и коррозия под напряжением.
Коррозионные процессы отличаются широким распространением и разнообразием условий и сред, в которых они протекают. Сегодня каждая научная область — физика, химия, биология — классифицирует коррозионные процессы, основываясь на собственных научных позициях, а единой, всеобъемлющей и общепризнанной классификации коррозии пока не создано. На наш взгляд, лучше всего рассматривать процесс коррозии с точки зрения физико-химической механики, так как она максимально объединяет научные течения, что, в свою очередь, дает возможность получить наиболее полную картину видов коррозии.
Так или иначе, сегодня существует несколько классификаций коррозии по различным признакам (см. «Классификация коррозии по различным признакам»). При этом надо учитывать, что на практике гораздо чаще встречается совмещение видов коррозии, нежели какой-либо вид в отдельности.
ХИМИЧЕСКАЯ КОРРОЗИЯ
По механизму протекания процесса различают химическую и электрохимическую коррозию. Химическая коррозия представляет собой взаимодействие поверхности металла с коррозионноактивной средой, не сопровождающееся возникновением электрохимических процессов на границе фаз. В этом случае окисление металла и восстановление окислительного компонента коррозионной среды протекают в одном акте. Например, образование окалины при взаимодействии материалов на основе железа при высокой температуре с кислородом:
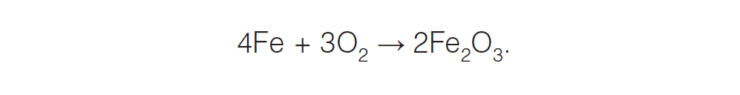
Общая химическая коррозия может протекать как компонентно-избирательная или структурно-избирательная, а локальная коррозия может быть межкристаллитной или носить язвенный характер (такой может быть ванадиевая коррозия).
По природе коррозионной среды различают коррозию в кислородсодержащих или серосодержащих газах, водородную, ванадиевую, галогенидную коррозию, коррозию в расплавах серы и других неметаллах. Эти виды коррозии проявляются в случае, если коррозионная среда не является электропроводной, то есть когда металл соприкасается с газами при высоких температурах и конденсация влаги на поверхности металла исключается. Поэтому при подборе материалов, пригодных для эксплуатации в условиях газовой коррозии, следует сочетать их устойчивость к окислению (жаростойкость) с высокой прочностью при повышенных температурах (жаропрочность).
Так, если речь идет об обработке черных металлов при изготовлении тех или иных прокатных изделий, то часто на основном металле появляется несколько слоев окалины, имеющих разное количество кислорода, который диффундирует и соединяется с основным металлом.
При кислородной коррозии стали происходит ее обезуглероживание. Углерод в стали находится в виде цементита (Fе3C), который образуется в процессе термообработки и обеспечивает высокую прочность материала. Под воздействием кислорода цементит окисляется, и сталь теряет свои прочностные свойства в поверхностных слоях.
В чугуне углерод содержится не только в виде цементита, но и в форме пластинчатого графита, который располагается по границам зерен металла, где происходит наиболее интенсивная диффузия кислорода. Окислению подвергаются, соответственно, участки металла, расположенные на границе зерен. Поскольку продукты окисления имеют больший объем, чем металл, из которого они образовались, происходит увеличение объема металла — явление, известное как «рост чугуна».
В связи с этим можно вспомнить, как в начале 1990-х годов отечественные заводы стали изготавливать нирезист (никелевый чугун), не представляя, к чему может привести эксплуатация изделий из него в условиях низких температур, когда происходит диффундирование кислорода в шаровидный графит. В итоге насосные установки, ступени которых были изготовлены из нирезиста и пролежавшие какое-то время на открытом воздухе в Западной Сибири, оказались непригодными для эксплуатации из-за увеличившегося объема металла.
КОРРОЗИЯ В КИСЛОРОД- И СЕРОСОДЕРЖАЩИХ СРЕДАХ
Кислородсодержащие газы вызывают снижение поверхностной прочности металлов, вследствие чего они оказываются подверженными более интенсивному износу. Причина этого явления также заключается в удалении цементита из поверхностных слоев металла. Износ топочного оборудования при высоких температурах происходит из-за его контакта с газом, омывающим трубы при большой скорости. Вместе с газом перемещаются и твердые частицы топлива и шлака, обладающие абразивными свойствами. Кроме того, в топочных газах обычно содержится окись углерода, которая при температурах 250–400°С способна реагировать с металлами, образуя летучие продукты (карбонилы), уносящиеся вместе с топочными газами. Этот вид коррозии называется карбонильной коррозией металла.
При сгорании наблюдаются достаточно высокие скорости движения горячих газов, в которых может содержаться кокс и различные окислы. Все это приводит к появлению большой эрозионной составляющей износа оборудования.
В серосодержaщих высокотемпературных газах на поверхности железа, стали, чугунов и других металлов образуется сульфидная или смешанная окалина, которая обладает свойствами, близкими к свойствам кислородной окалины. Она служит препятствием для диффузии реагентов друг в друга и имеет защитное действие. Некоторые виды окалины, например сульфидная окалина никеля, образуют с никелем легкоплавкие вещества, и в этом случае возможен переход химической газовой коррозии в высокотемпературную электрохимическую.
ВОДОРОДНАЯ И ГАЛОГЕНИДНАЯ КОРРОЗИЯ
Водородная коррозия возникает при диффузии водорода в сталь и другие материалы при высоких температурах, что наблюдается, например, в аппаратуре для синтеза аммиака или переработки метана. Она вызывает изменение механических свойств металлов: повышение хрупкости стали, ее расслоение и пузырение. Хрупкое разрушение при водородной коррозии в большей степени характерно для высокоуглеродистой стали, имеющей высокие прочностные показатели, тогда как для мягких сталей типично расслоение и пузырение.
Учитывая, что метан при определенных условиях легко разделяется на углерод и водород, водородная коррозия может возникать в аппаратах и сосудах, работающих под давлением с природными и попутными нефтяными газами. Метан собирается в отдельных пустотах, трещинах, дефектах металла, вызывая внутренние напряжения, из-за которых приходится снижать рабочие нагрузки на детали. В результате в мягких сталях возникают пузыри, и металл расслаивается, а высокопрочные стали при относительно небольших механических нагрузках подвергаются хрупкому разрушению.
Медь, а также некоторые ее сплавы могут быть склонны к водородной коррозии в тех случаях, когда недостаточно глубоко проведено их раскисление в процессе металлургического производства, то есть когда в металле сохранился кислород, например, в виде закиси меди Cu2O. Этот оксид образует отдельную фазу в металле, а проникающий в металл водород, химически взаимодействуя с ним, восстанавливает его. Образуется водяной пар, который при высокой температуре может быть причиной возникновения хрупкости меди.
Все это следует принимать во внимание при использовании порошковых материалов для изготовления центробежных колес и управляющих аппаратов ЭЦН, которые во многих случаях не выдерживают условий эксплуатации, и это связано как раз с возникновением хрупкости меди, которая используется в порошковых ступенях как связующий материал. В результате ухудшается работа направляющих аппаратов и рабочих колес, в них возникают зоны, которые промываются потоком пластовой жидкости.
Некоторые металлы, например титан, способны поглощать (абсорбировать) большие количества кислорода при высокой температуре. Если такой металл оказывается затем в контакте с водородом, то также может наблюдаться водородная коррозия, снижающая его прочность. Учитывая, что многие аппараты, работающие под давлением, изготовлены из стали типа 09Х13Н2Т, где содержится до 1,5% титана, следует обязательно принимать во внимание вопросы температурного напряжения и, соответственно, контакта со свободным водородом и кислородом титана, который используется для изготовления этих видов оборудования.
Галогенидная коррозия представляет собой процесс коррозии металлов в хлористом водороде, хлоре, фторе, броме, йоде с образованием галогенидов. Обычно при низких температурах большинство металлов слабо взаимодействует с такими веществами, но при температурах 200–300°С происходит самоускорение этих реакций, и некоторые металлы буквально «сгорают». Это нужно помнить при разработке месторождений, в пластовой воде которых содержится значительное количество галогенов. При воздействии на пласт термическими способами, при откачке жидкости с помощью центробежных насосов, температура может достигать величины, при которой возникает галогенидная коррозия.
МЕТОД ПАРЦИАЛЬНОГО ДАВЛЕНИЯ
Чтобы определить возможность окисления металла и, соответственно, вероятность начала коррозионного процесса, часто используют метод парциального давления. При этом, например, в кислородсодержащих газах сопоставляют парциальное давление кислорода в газовой смеси (коррозионной среде) и давление распада (диссоциации) окисла металла.
Например, сопоставляя табличную величину давления диссоциации оксида меди, равную 0,31, с парциальным давлением кислорода в воздухе, равным 0,21, можно сделать заключение, что в воздухе окисления меди быть не может, поскольку парциальное давление кислорода меньше табличной величины диссоциации оксида меди.
ОБРАЗОВАНИЕ ПЛЕНОК ИЗ ПРОДУКТОВ КОРРОЗИИ
В результате взаимодействия металла и коррозионной среды образуются газообразные, жидкие или твердые продукты. От их свойств и агрегатного состояния зависит, в какой степени образующиеся продукты влияют на скорость взаимодействия металла с коррозионной средой.
Так, газообразные продукты удаляются с поверхности, не препятствуя взаимодействию окислителя с металлом.
Твердые продукты могут образовать пленку на поверхности металла, и развитие взаимодействия металла с окислителем вследствие этого может быть затруднено.
Жидкая пленка продуктов также может затруднять коррозионное взаимодействие, но в меньшей степени, чем твердая. Если жидкая пленка электропроводна, коррозионный процесс из химического может превратиться в электрохимический. Это важно учитывать, так как скорость электрохимического процесса при высоких температурах может быть более высокой по сравнению со скоростью химической коррозии.
Для высокотемпературной газовой коррозии наиболее характерны взаимодействия металлов с окислителями через пленки твердых продуктов коррозии. Если пленка сплошная, то скорость коррозии снижается, и тогда пленку называют защитной.
Важно знать, как меняется объем окисла металла по сравнению с первоначальным объемом того металла, который входит во взаимодействие с окислителем. Когда объем продукта коррозии меньше объема металла, из которого эта пленка сформировалась, возникают внутренние напряжения растяжения, которые служат причиной разрывов и трещин в пленках. Через них окислитель свободно проникает к поверхности металла, и процесс коррозии продолжается.
Если объем продукта коррозии значительно больше объема металла, из которого он образуется, то в пленке возникают напряжения сжатия, приводящие к вздутию, которое возможно при недостаточном сцеплении пленки с металлом. Отрыв пленки сопровождается сколами, облегчающими подход окислителя к металлу, и скорость коррозии возрастает. В тех случаях, когда пленка хорошо связана с металлом, силы сжатия обеспечивают скол оксидной пленки. Часть продукта «выталкивается», и скорость коррозии также возрастает.
ОСОБЕННОСТИ ЭЛЕКТРОХИМИЧЕСКОЙ КОРРОЗИИ
Электрохимическая коррозия металла происходит в средах, имеющих ионную проводимость (в расплавах и растворах электролитов), и отличается от химической механизмом протекания. При электрохимической коррозии всегда требуется наличие электролита — конденсата, пластовой воды и т.д. Например, при ржавлении железа во влажной атмосфере появляется ржавчина. Это записывается следующей формулой:
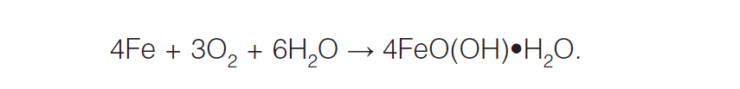
Особенность электрохимической коррозии заключается в том, что две сопряженные реакции — окисле-ние металла и восстановление окислителя осуществляются на различных участках поверхности ме-таллов. Процессы электрохимической коррозии подобны процессам, протекающим в гальванических элементах. Но, поскольку в коррозионном элементе анод и катод непосредственно соприкасаются друг с другом, то он является короткозамкнутым, то есть в нем отсутствует внешняя цепь.
Электрохимическая коррозия может протекать в электролитах — водных растворах солей, кислот, щелочей, морской воде, в атмосфере любого влажного газа и в почве.
Особым видом электрохимической коррозии следует считать коррозию за счет внешнего электрического тока. В качестве примеров подобного рода разрушений можно привести части оборудования, которые потребляют электроэнергию и находятся под уровнем жидкости: трубопроводы с токопроводящими жидкостями, подземные металлические сооружения. В этом случае происходит не только коррозия в электролитах, но и наблюдается постоянный контакт между двумя элементами, имеющими разный потенциал.
Механизм электрохимической коррозии состоит в следующем. Коррозия металла в растворах электролитов протекает через анодное окисление металла.
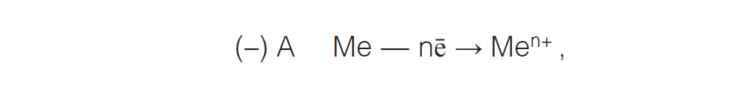
а также катодное восстановление окислителя (деполяризатора D):

Схема коррозионного гальванического элемента может быть представлена следующим образом:
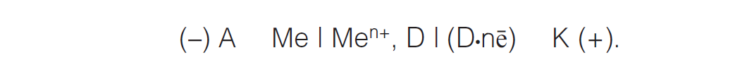
Важнейшими деполяризаторами, вызывающими коррозию, являются растворенный кислород (O2) и ионы водорода (H+).
Электродами при реакции выступают либо различные элементы структуры материала, либо два различных соприкасающихся материала. Если в воде растворены ионы солей, ее электропроводность повышается и скорость процесса увеличивается. Особенно заметно катализируют процесс коррозии хлорид-ионы, содержащиеся в морской, пластовой воде или в воде, образовавшейся при таянии снега зимой, когда дороги посыпают солью. С получающимися в процессе коррозии Fe(3+)-ионами ионы хлора образуют растворимые комплексы (FeCl4-), что способствует ускорению окисления металла.
При соприкосновении двух металлов с различными окислительно-восстановительными потенциалами и погружении их в раствор электролита, например, дождевой воды с растворенным углекислым газом CO2, образуется гальванический элемент, который, соответственно, действует как коррозионный элемент. Он представляет собой не что иное, как замкнутую гальваническую ячейку, в которой происходит медленное растворение металлического материала с отрицательным окислительно-восстановительным потенциалом. Этот вид коррозии присущ металлам с высокими отрицательными потенциалами, поэтому даже небольшого количества примеси на поверхности металла с большим отрицательным потенциалом достаточно для образования коррозионного элемента. Особенно подвержены риску места соприкосновения металлов с различными потенциалами, например, сварочные швы или заклепки, элементы датчиков.
ВОДОРОДНАЯ И КИСЛОРОДНАЯ КОРРОЗИЯ
Коррозия металлов часто подразделяется на водородную и кислородную.
Если происходит восстановление ионов H3O+ или молекул воды H2O, говорят о водородной коррозии, или коррозии с водородной деполяризацией. Восстановление ионов происходит по следующей схеме:

Если водород не выделяется, что часто происходит в нейтральной или сильнощелочной среде, происходит восстановление кислорода и возникает кислородная коррозия, или коррозия с кислородной деполяризацией:
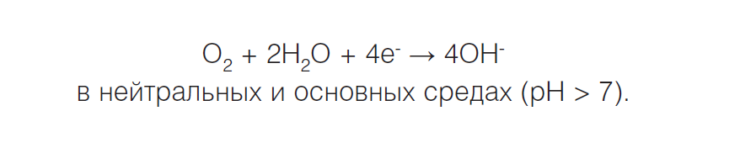
Коррозионный элемент может образовываться не только при соприкосновении двух различных металлов, но и в случае использования одного металла, если, к примеру, структура его поверхности неоднородна.
Исходя из того, что возникновение коррозии возможно только при уменьшении энергии поверхностных сил в том или другом материале, возможность коррозии с водородной и кислородной деполяризацией может быть установлена с помощью формулы, связывающей энергию Гиббса и напряжение гальванического элемента:
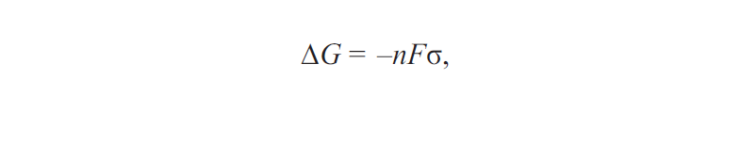
где G — энергия Гиббса; n — напряжение гальванического элемента; F — площадь гальванического элемента; σ — коэффициент, зависящий от материала гальванического элемента.
Коррозия возможна при условии, если ΔG < 0.
В зависимости от величины потенциала металла по отношению к потенциалу водородного или кислородного электрода, металлы можно разделить на три группы.
Если потенциал металла отрицательнее потенциала водородного электрода, то возможна коррозия как с поглощением кислорода, так и с выделением водорода. К таким металлам относятся щелочные и щелочноземельные металлы: Al, Zn и др.
Если потенциал металла положительнее потенциала водородного электрода и отрицательнее потенциала кислородного электрода, то коррозия возможна с поглощением кислорода и невозможна с выделением водорода. К этим металлам относятся Cd, Ni, Sn и др. Если потенциал металла положительнее потенциа ла кислородного электрода, то коррозия металла невозможна. Это — благородные металлы, например Au, Ag, Pt.
ОСНОВНЫЕ СЛУЧАИ ВОЗНИКНОВЕНИЯ КОРРОЗИОННЫХ ГАЛЬВАНИЧЕСКИХ ПАР
Коррозионные гальванические пары могут возникать при контакте двух металлов, а также металла с токопроводящими неметаллическими примесями.
В результате соприкосновения двух разных металлов в присутствии электролита возникает электрохимическая коррозия. Электролитом может быть морская или природная вода, в которой всегда присутствуют соли, растворенные газы (CO2, SO2) и т.д. Примером может быть коррозия изделия из железа, находящегося в контакте с медью, в растворе электролита (рН = 10).
Так как в контакте находятся железо и медь со стандартными электродными потенциалами (j°Fe/Fe2+= –0,44 В; j°Cu/Cu2+ = +0,34 В), то при замыкании в электролите двух тел, имеющих различные потенциалы, пойдет электрический ток — перемещение электронов от более отрицательного электрода (железа) к более положительному электроду (меди). При этом железо будет разрушаться: ионы Fe2+ будут переходить из металлической решетки в электролит. Электроны, поступающие к меди, расходуются в процессе восстановления. Какой именно процесс восстановления будет протекать на поверхности меди, зависит от состава электролита.
Антикоррозионные свойства в значительной степени зависят от чистоты металла и однородности сплава. Так, наличие примеси (Ме2) на поверхности основного металла (Ме1) при контакте с электролитом обусловливает возникновение гальванических микроэлементов вида: Me1 | электролит | Me2.
В этих элементах металл с меньшей величиной электродного потенциала выполняет функцию анода и разрушается. Примером может служить порошковая металлургия в колесах центробежных насосов: присутствие в порошке железа и меди приведет без добавления легирующих элементов к возникновению коррозии.
Если в металле имеются включения неметаллов, оксидов, нитридов или карбидов, это также приводит к возникновению электрохимической коррозии. Например, в стали есть кристаллы собственно железа и кристаллы цементита Fe3C, которые по отношению к железу выступают в роли катода в микрогальваническом элементе: Fe (анод) | электролит | Fe3C (катод).
Похожим образом обстоит дело с серым чугуном, который легко ржавеет в присутствии влаги из-за образования в наружном слое микроэлементов из железа и графита. В этих случаях микровключения как химически неактивные, по сравнению с металлом, образования выполняют функцию катода, а металл — анода. Схема такого микрогальванического элемента имеет вид:
Металл | электролит | неметаллические включения. Несмотря на то что серый чугун довольно хорошо сопротивляется ржавлению, его, тем не менее, нельзя использовать для ЭЦН коррозионностойкого исполнения без легирующих элементов.
МЕТОДЫ ЗАЩИТЫ МЕТАЛЛОВ ОТ КОРРОЗИИ
Коррозию металлов можно затормозить изменением потенциала металла, пассивированием металла, изменением состава металла, изоляцией поверхности металла от окислителя, снижением концентрации окислителя и др. Выбор того или иного способа определяется его экономичностью и эффективностью в каждом случае.
Все методы защиты от коррозии можно условно разделить на пять групп, при этом для повышения эффективности защиты допускается одновременное использование двух и более методов.
Первая группа методов: создание рациональных конструкций. Создание рациональных конструкций подразумевает, что выбор материалов и их сочетания должны обеспечивать высокую коррозионную устойчивость, а форма узлов и деталей — допускать быструю очистку и смазку.
Вторая группа методов: защитные покрытия. Защитные покрытия представляют собой слои, искусственно создаваемые на поверхности металлических изделий и сооружений для предохранения их от коррозии. Защитные покрытия бывают металлические и неметаллические. Выбор вида покрытия зависит от условий, в которых используется изделие из металла. Методы нанесения металлических защитных слоев разнообразны, их делят на высокотемпературные и электрохимические.
К высокотемпературным методам можно отнести следующие.
Во-первых, метод окунания, который применяют для нанесения покрытий из легкоплавких металлов на более тугоплавкие. Так покрывают стальные листы оловом, цинком и свинцом. Сущность метода сводится к тому, что в расплавленный металл, из которого хотят приготовить покрытие, через слой флюса погружают стальной лист и затем вынимают его, в результате чего металл кристаллизуется на поверхности.
Во-вторых, металлизация, которая представляет собой нанесение металлических покрытий на поверхность изделия путем распыления жидкого металла. Распыление осуществляется в дуговом, искровом или плазменном разряде.
В-третьих, планкирование — нанесение пленок из защитного металла путем совместного проката. Этот метод используется для листов, прутков, угольников. Примером может служить дюраль, планкированный алюминием, сталь, планкированная нержавеющей сталью.
Электрохимические методы нанесения металлических покрытий основаны на электролизе. Металлические защитные слои осаждаются на поверхности изделия, которое в электролизере представляет собой катод.
В качестве материалов для металлических покрытий могут использоваться как чистые металлы (цинк, кадмий, алюминий, никель, медь, хром, серебро и др.), так и их сплавы (бронза, латунь и др.). В зависимости от активности металла, выполняющего роль защитного покрытия, различают катодные и анодные покрытия.
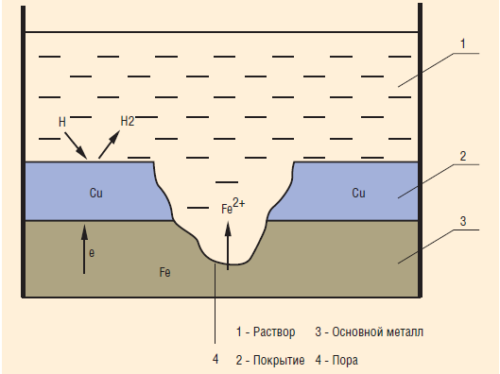
К катодным относят покрытия, потенциалы которых в данной среде имеют более положительные значения по сравнению с потенциалом защищаемого металла (см. «Схема коррозии металла в кислом растворе при нарушении катодного покрытия»).
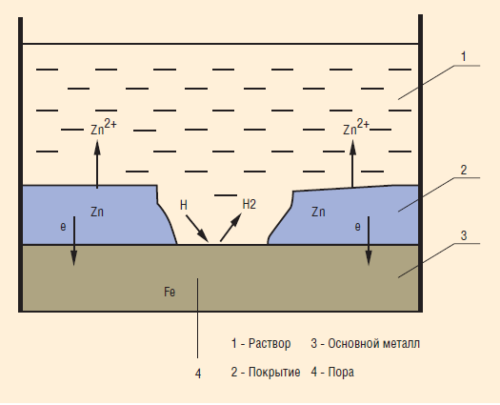
К анодным покрытиям относят покрытия, потенциалы которых в данной среде имеют более отрицательные значения, чем потенциал защищаемого (основного) металла. Так, для анодного покрытия стали служит цинк. В этом случае основной металл будет катодом коррозионного элемента, поэтому он не корродирует (см. «Схема коррозии металла в кислом растворе при нарушении анодного покрытия»).
Неметаллические защитные покрытия бывают как органическими, так и неорганическими. Их защитное действие главным образом сводится к изоляции металла от окружающей среды.
В качестве неорганических покрытий применяют неорганические эмали, оксиды металлов, соединения хрома, фосфора и др. Эмалированию подвергаются черные и цветные металлы, которые используют в производстве аппаратуры для химической и пищевой отраслей промышленности, в производстве изделий домашнего обихода. Неорганические эмали по своему составу — силикаты. В качестве основного недостатка таких покрытий можно назвать хрупкость и растрескивание при тепловых и механических ударах. Впрочем, в процессе совершенствования состава покрытий эти недостатки постепенно минимизируются: на сегодняшний день уже создано несколько видов силикатных эмалей и специальных оксидов, которые позволяют работать при достаточно больших ударных нагрузках и значительной амплитуде температур.
Образование на поверхности металлических изделий защитных оксидных пленок при химической обработке металла называют оксидированием. Вместе с оксидированием может применяться заполнение оксидного слоя специальными полимерами, которые исключают проникновение окислителей через поры к основному металлу, а также улучшают условия работы элементов при контакте — например, уменьшают трение (см. «Ступень ЭЦН с керамо-полимерным покрытием, создаваемым на поверхности металлических деталей методом плазменного электролитического оксидирования»). Некоторые процессы имеют специальные названия. Так, процесс нанесения на сталь оксидных пленок называют воронением, а электрохимическое оксидирование алюминия — анодированием.
Фосфатные покрытия на стали получают из растворов ортофосфорной кислоты и ортофосфатов марганца и цинка (например, ZnHPO4 + H3PO4). При реакции образуется пористый кристаллический фосфат металла, хорошо сцепленный с поверхностью стали. Сами по себе фосфатные покрытия не обеспечивают достаточной защиты от коррозии, поэтому их используют в качестве подложки под краску, что повышает сцепление лакокрасочного покрытия со сталью и уменьшает коррозию в местах царапин.
К органическим относятся лакокрасочные покрытия, покрытия смолами, пластмассами, полимерными пленками, резиной. При защите подземных трубопроводов применяют обмотку их полиэтиленом в виде липкой изоляционной ленты.
Наиболее распространено и практически незаменимо лакокрасочное покрытие, которое должно быть сплошным, беспористым, газои водонепроницаемым, химически стойким, эластичным, обладать высоким сцеплением с материалом, механической прочностью и твердостью.
Лакокрасочные покрытия делят на две группы: лаки и краски (эмали). Эмали представляют собой смесь нерастворимых частиц пигмента, взвешенных в однородном органическом связующем. Лаки обычно состоят из смеси смолы или высыхающего масла с летучим растворителем.
Третья группа методов: легирование металлов.
Легирование металлов — эффективный, но дорогостоящий путь повышения коррозионной стойкости металлов. При легировании в состав сплава вводят компоненты, вызывающие пассивацию металла: хром, никель, вольфрам и др. Легирование может быть поверхностным и объемным.
Поверхностное легирование представляет собой насыщение поверхности сплава металлом, который при высоких температурах окисляется энергичнее, чем железо, и образует при этом плотную защитную пленку оксида. Так, легирование стали осуществляют алюминием (алитирование), хромом (хромирование) или кремнием (силицирование).
Объемное легирование применяется более часто. Его проводят одновременно с получением того или иного конструкционного материала. Так, хром и никель, введенные в сталь, диффундируя к поверхности, образуют оксидный слой, содержащий шпинели состава: NiO·Cr2O3 и FeO·Cr2O3.
Примерами могут служить нирезист (никелевый чугун с 14–28%-ным содержанием никеля), сталь 15Х2М2Н3Ф для штанг, сталь 20Х13 для ЦНС.
Четвертая группа методов: изменение свойств коррозионной среды. Суть этих методов заключается в уменьшении концентрации опасных в коррозионном отношении компонентов для снижения агрессивности среды. Например, агрессивность среды можно уменьшить снижением концентрации ионов H+, то есть повышением рН: для этого в воду
добавляют NaOH, Na3PO4, NH3. При рН = 8,8 коррозия с водородной деполяризацией практически прекращается.
Применение этих методов не всегда экономически оправдано, учитывая, что подавляющая часть коррозионной среды не соприкасается с оборудованием.
Также для защиты от коррозии широко применяют ингибиторы. Это вещества, которые пассивируют поверхность металлов и препятствуют развитию коррозионных процессов. Ингибиторами могут быть как неорганические, так и органические вещества. Неорганические вещества применяются редко, главным образом при травлении металлов. Кислые растворы (H2SO4, H3PO4) растворяют оксидную пленку на металле, а потом начинают растворять и сам металл. При добавлении соединений свинца — (CH3COO)2Pb — свинец осаждается на металлической поверхности, обнаженной от оксидной пленки, и прекращает ее растворение:
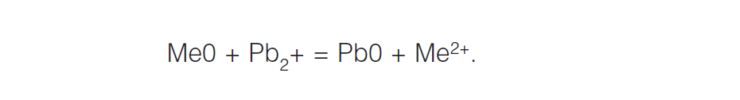
Пятая группа методов: электрохимическая защита. Среди методов электрохимической защиты различают анодную, катодную и протекторную защиту. Этот метод основан на торможении анодных и катодных реакций коррозионного процесса. При работе коррозионной гальванической пары активный участок, анод, разрушается и переходит в ионное состояние, развивая при этом некоторый отрицательный потенциал. Если на изделие извне наложить больший отрицательный потенциал, чем развивает анод, то процесс коррозии прекратится.
Метод протекторов заключается в том, что к изделию, подвергающемуся электрохимической коррозии, подключают деталь — протектор, изготовленный из еще более активного металла, чем металл изделия. В этом случае протектор (анод) будет разрушаться, а изделие (катод) останется неизменным. Для изготовления протекторов большей частью используют магний и его сплавы, цинк, алюминий. Применение протектора необходимо, если, например, для защиты стального вала ЭЦН используются бронзовые или латунные защитные втулки. Втулки имеют меньшую активность с точки зрения поляризации, что без применения протектора может привести к быстрому разрушению стального вала.
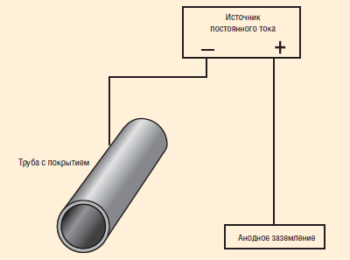
Метод внешнего потенциала, или так называемая катодная защита, заключается в том, что защищаемое изделие подключается к отрицательному полюсу внешнего источника постоянного тока, следовательно, оно становится катодом, тогда как анодом служит вспомогательный электрод (см. «Схема катодной защиты»). Анод растворяется, на катоде выделяется водород. Катодную защиту применяют к подземным трубопроводам, кабелям, оборудованию химических заводов.
ВЫДЕРЖКИ ИЗ ОБСУЖДЕНИЯ
Но хотелось бы еще раз подчеркнуть, что в большинстве случаев речь идет об определении не единственного вида коррозии, а доминирующего среди прочих.
В данном случае механизм разрушения заключается в том, что атомарный водород внедряется в кристаллическую решетку и «выбивает» из нее отдельные атомы металла. Начинается изменение структуры решетки, что приводит к возникновению электрохимической пары. По мере замены атомов металла на атомы водорода уменьшается связь между узлами решетки, происходит снижение микротвердости металла и повышение его хрупкости. Если давление атомарного водорода повышается, это приводит к разрыву кристаллической решетки. Как я уже говорил, хрупкое разрушение при водородной коррозии в большей степени характерно для высокоуглеродистой стали, имеющей высокие прочностные показатели, тогда как для мягких сталей типично расслоение и пузырение..



Для отправки комментария вам необходимо авторизоваться.